軌道の節について
原子軌道 1s、2s、2p、3d を導出は次の手順で行われる。
(1) 動径波動関数の導出
(2) 球面調和関数の導出
(3) 原子軌道の導出
n=主量子数、l=方位量子数、m=磁気量子数
方位量子数 l=0 の軌道をs軌道
方位量子数 l=1 の軌道をp軌道
方位量子数 l=2 の軌道をd軌道
さらに、次のように分類する。
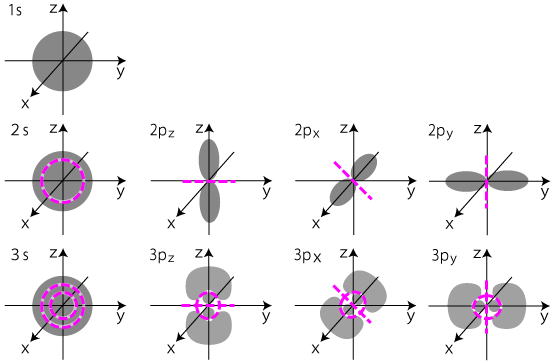
1s軌道 (n、l、m)=(1、0、0)
2s軌道 (n、l、m)=(2、0、0)
2p軌道 (n、l、m)=(2、1、0)
2p軌道 (n、l、m)=(2、1、1)
2p軌道 (n、l、m)=(2、1、-1)
3s軌道 (n、l、m)=(3、0、0)
3p軌道 (n、l、m)=(3、1、0)
3p軌道 (n、l、m)=(3、1、1)
3p軌道 (n、l、m)=(3、1、-1)
節面の数 = 主量子数 − 1
方位量子数が増えると、球面状の節面が減り、非球面の節面が増える。
詳しくは、量子化学を勉強する必要があります。
(1) 動径波動関数の導出
(2) 球面調和関数の導出
(3) 原子軌道の導出
n=主量子数、l=方位量子数、m=磁気量子数
方位量子数 l=0 の軌道をs軌道
方位量子数 l=1 の軌道をp軌道
方位量子数 l=2 の軌道をd軌道
さらに、次のように分類する。
1s軌道 (n、l、m)=(1、0、0)
2s軌道 (n、l、m)=(2、0、0)
2p軌道 (n、l、m)=(2、1、0)
2p軌道 (n、l、m)=(2、1、1)
2p軌道 (n、l、m)=(2、1、-1)
3s軌道 (n、l、m)=(3、0、0)
3p軌道 (n、l、m)=(3、1、0)
3p軌道 (n、l、m)=(3、1、1)
3p軌道 (n、l、m)=(3、1、-1)
節面の数 = 主量子数 − 1
方位量子数が増えると、球面状の節面が減り、非球面の節面が増える。

詳しくは、量子化学を勉強する必要があります。
講義関連TOPに戻る
